မီးရောင် ပဲ့တင်ရိုက်ခတ်မှု စွမ်းအင် လွှဲပြောင်းခြင်း (FRET)
Fluorescence resonance energy transfer (FRET) သည် intermolecular electric couple များ၏ အပြန်အလှန်အားဖြင့် အလှူရှင် စိတ်လှုပ်ရှားနေသော အခြေအနေစွမ်းအင်ကို လက်ခံသူ စိတ်လှုပ်ရှားနေသော အခြေအနေသို့ လွှဲပြောင်းပေးသည့် ဓါတ်ရောင်ခြည်မဟုတ်သော စွမ်းအင်လွှဲပြောင်းသည့် လုပ်ငန်းစဉ်တစ်ခုဖြစ်သည်။ဤလုပ်ငန်းစဉ်တွင် ဖိုတွန်များမပါဝင်သောကြောင့် ဓာတ်ရောင်ခြည်သင့်ခြင်းမဟုတ်ပေ။ဤဆန်းစစ်မှုတွင် မြန်ဆန်ခြင်း၊ ထိလွယ်ရှလွယ်နှင့် ရိုးရှင်းခြင်း၏ အားသာချက်များရှိသည်။
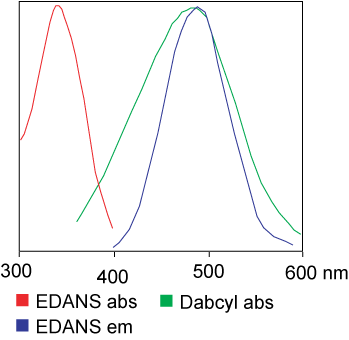
FRET စစ်ဆေးမှုတွင် အသုံးပြုသည့် ဆိုးဆေးသည် တူညီနိုင်သည်။ဒါပေမယ့် Application အများစုမှာ မတူညီတဲ့ ဆိုးဆေးတွေကို အမှန်တကယ် အသုံးပြုကြပါတယ်။အတိုချုပ်အားဖြင့်၊ အလှူရှင်အဖွဲ့ စိတ်လှုပ်ရှားနေချိန်တွင် အလှူရှင် (ဆိုးဆေး ၁) မှ လက်ခံသူ (ဆိုးဆေး ၂) ၏ တောက်ပသော ပဲ့တင်ထပ်သော စွမ်းအင်ကို လွှဲပြောင်းပေးခြင်းသည် အလှူရှင်အဖွဲ့မှ စိတ်လှုပ်ရှားနေချိန်ဖြစ်သည်။ယေဘုယျအားဖြင့်၊ Donor fluorophore အုပ်စု၏ ထုတ်လွှတ်မှု spectrum သည် Acceptor အုပ်စု၏ စုပ်ယူမှု spectrum နှင့် ထပ်နေပါသည်။"ဖလိုရိုဖီးယား နှစ်ခုကြား အကွာအဝေးသည် သင့်လျော်သောအခါ (10 မှ 100 A)၊ အလှူရှင်ထံမှ ဖလိုရိုဖီးယား စွမ်းအင်ကို လက်ခံသူထံ လွှဲပြောင်းခြင်းကို စောင့်ကြည့်နိုင်သည်။"စွမ်းအင်လွှဲပြောင်းမှုနည်းလမ်းသည် receptor ၏ဓာတုဖွဲ့စည်းပုံအပေါ် မူတည်သည်-
1. မော်လီကျူးတုန်ခါမှုအဖြစ်သို့ ပြောင်းလဲသွားသည်၊ ဆိုလိုသည်မှာ တောက်ပသော စွမ်းအင်လွှဲပြောင်းမှု ပျောက်သွားသည်။(ဓာတ်ခံသည် အလင်းကို ငြိမ်းစေသည်)၊
2. ထုတ်လွှတ်မှုသည် receptor ကိုယ်တိုင်ထက် ပိုမိုပြင်းထန်သောကြောင့် ဒုတိယ fluorescence spectrum တွင် အနီရောင်ပြောင်းသွားပါသည်။"(လက်ခံကိရိယာများသည် တောက်ပသော ထုတ်လွှတ်မှု)။
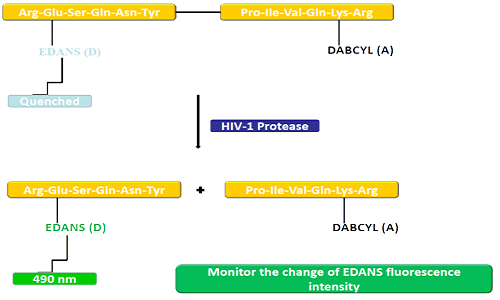
အလှူရှင်အုပ်စု (EDANS) နှင့် လက်ခံသူမျိုးရိုးဗီဇ (DABCYL) တို့သည် HIV ပရိုတင်း၏ သဘာဝအလွှာနှင့် တစ်ပုံစံတည်း ဆက်စပ်နေပြီး၊ အလွှာကို ချိတ်ဆက်ခြင်းမပြုသောအခါ၊ DBCYL သည် EDANS ကို နှိမ်နင်းနိုင်ပြီး ဖလိုရင်းကို သိရှိနိုင်မည်မဟုတ်ပေ။HIV-1 protease ချိတ်ဆက်မှုပြတ်တောက်ပြီးနောက်၊ EDANS သည် DBCYL ဖြင့် မငြိမ်းတော့ဘဲ၊ EDANS Luciferases ကို နောက်ပိုင်းတွင် ရှာဖွေတွေ့ရှိနိုင်သည်။Protease inhibitors များ၏ရရှိနိုင်မှုကို EDANS ၏ fluorescence ပြင်းထန်မှုပြောင်းလဲမှုများဖြင့်စောင့်ကြည့်နိုင်သည်။
FRET peptides များသည် peptidase အတိအကျမဟုတ်ခြင်းကို လေ့လာရန် အဆင်ပြေသောကိရိယာများဖြစ်သည်။၎င်း၏ တုံ့ပြန်မှုလုပ်ငန်းစဉ်ကို စဉ်ဆက်မပြတ် စောင့်ကြည့်နိုင်သောကြောင့် ၎င်းသည် အင်ဇိုင်းလှုပ်ရှားမှုကို ထောက်လှမ်းရန် အဆင်ပြေသောနည်းလမ်းကို ပေးဆောင်သည်။အလှူရှင်/လက်ခံသူမှ peptide bonds များကို hydrolysis ပြုလုပ်ပြီးနောက် ဖြစ်ပေါ်လာသော တောက်ပမှုသည် nanomolar concentrations တွင် အင်ဇိုင်းလုပ်ဆောင်ချက်ကို တိုင်းတာပေးပါသည်။FRET peptide သည် နဂိုအတိုင်းရှိသောအခါ၊ အတွင်း flash သည် ရုတ်တရက် ပျောက်ကွယ်သွားသည်ကို ပြသသည်၊ သို့သော် အလှူရှင်/လက်ခံသူနှင့် ဆန့်ကျင်ဘက်ရှိ peptide နှောင်ကြိုးများ ကွဲသွားသောအခါတွင် ၎င်းသည် flash တစ်ခု ထွက်လာသည်၊ ၎င်းသည် စဉ်ဆက်မပြတ် ရှာဖွေတွေ့ရှိနိုင်ပြီး အင်ဇိုင်းလုပ်ဆောင်ချက်ကို တိုင်းတာနိုင်သည်။
စာတိုက်အချိန်- သြဂုတ်-၁၄-၂၀၂၃